①25℃时,用pH试纸测溶液的pH为4
②水溶液中含有
分子和
、
③溶液恰好与
溶液完全反应
④次氯酸不稳定,在光照条件下易分解
⑤用溶液做导电性实验,灯泡很暗
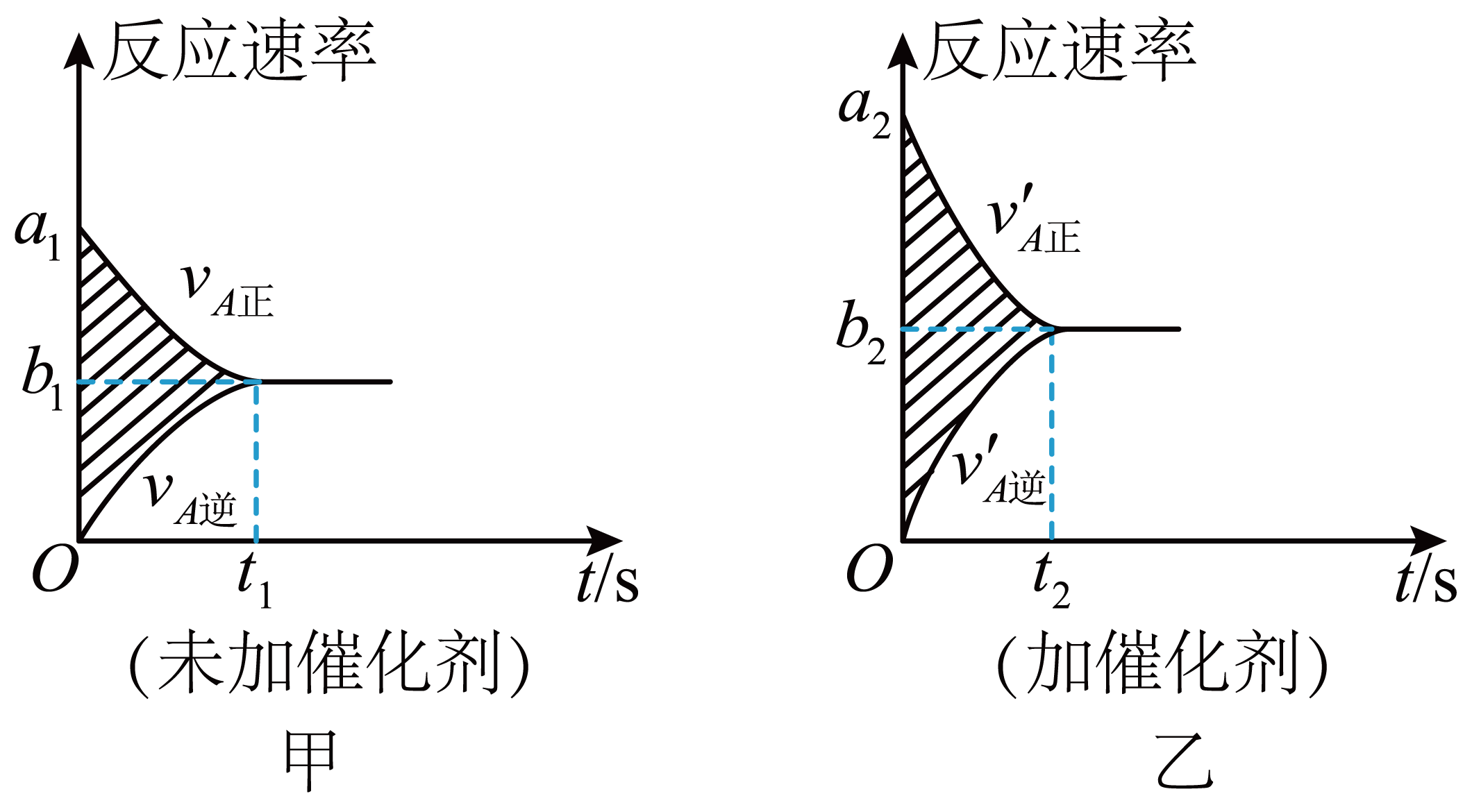
①②
③
④
⑤
⑥
⑦甲图与乙图中阴影部分的面积相等⑧图乙中阴影部分面积更大。
则以上所述各项正确的组合为( ___ )
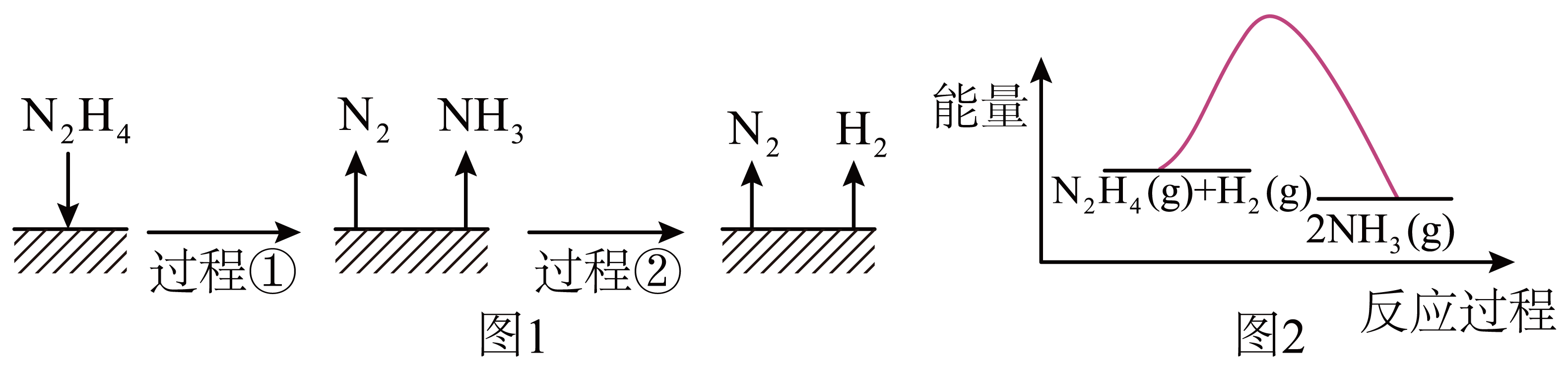
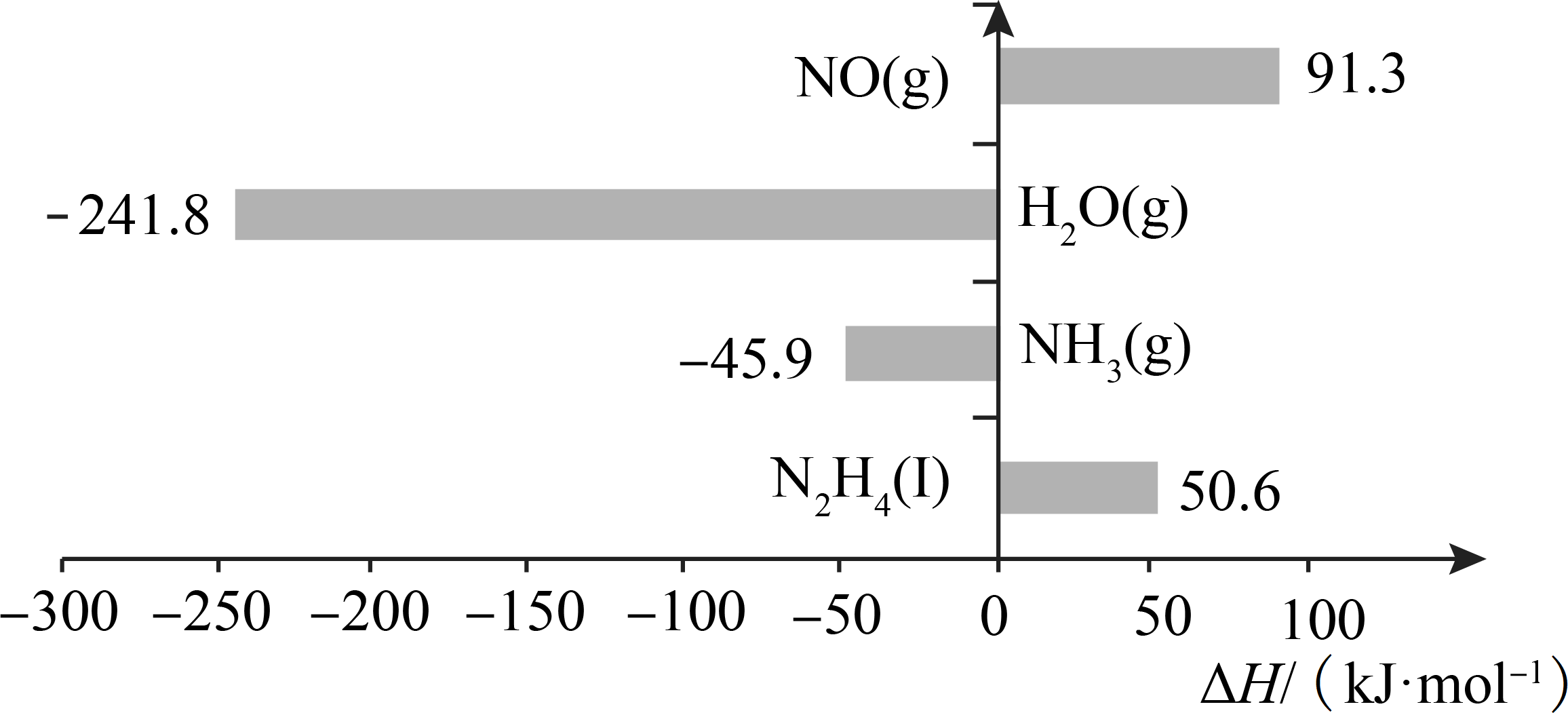
已知200℃时:
反应Ⅰ:
反应Ⅱ:
下列说法不正确的是( ___ )
酸 | HX | HY | HZ | ||
浓度/( | 0.12 | 0.2 | 0.9 | 0.9 | 0.9 |
电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
电离常数 | |||||
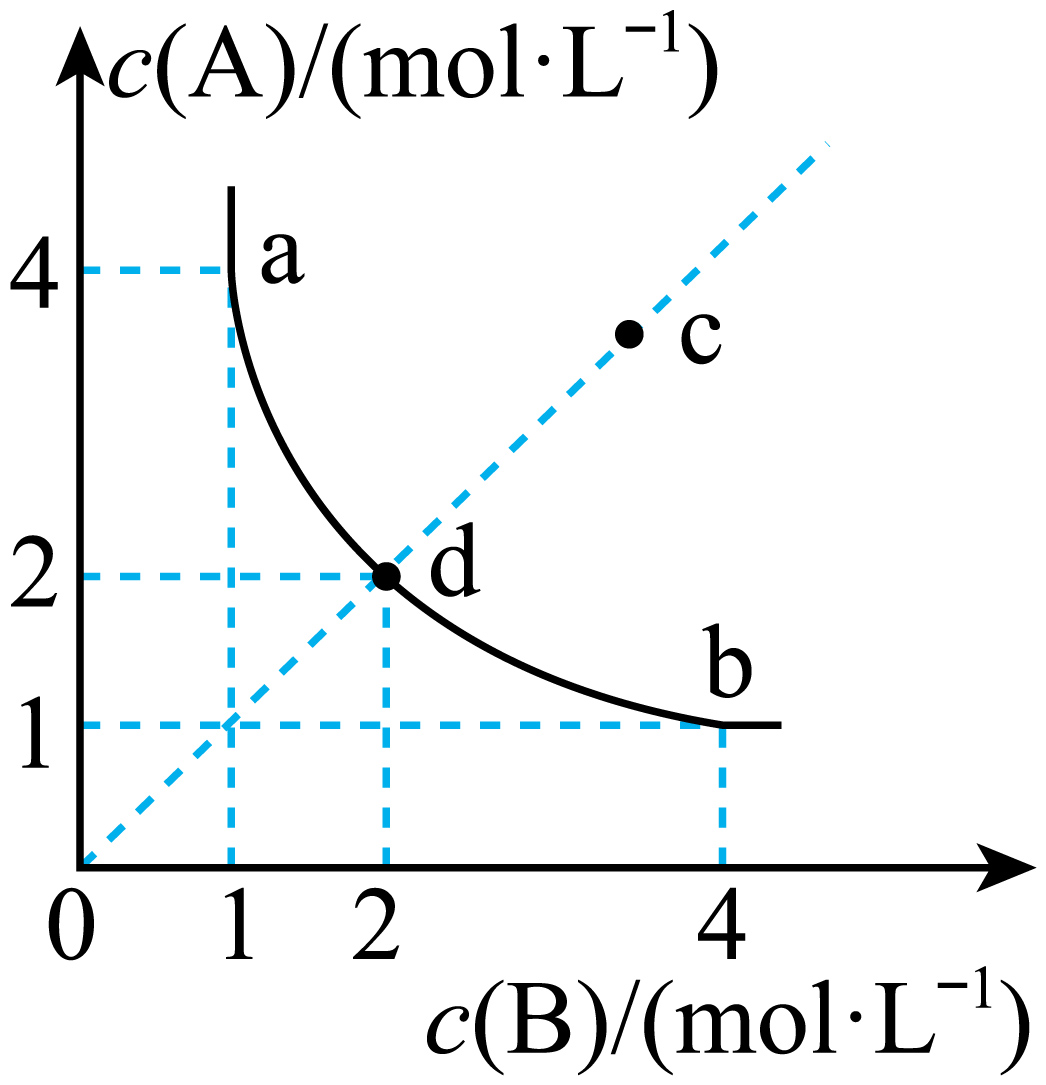
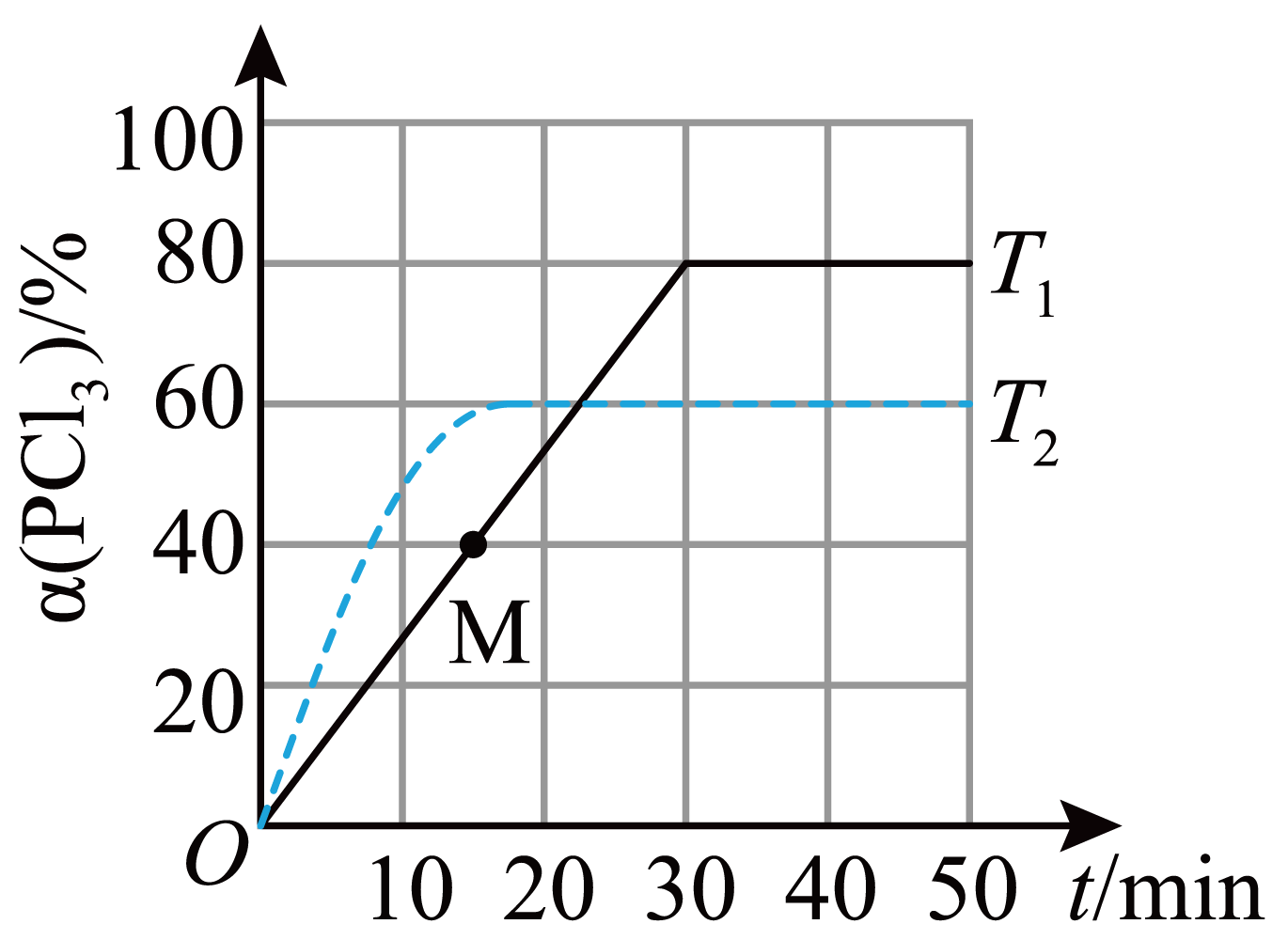

容器编号 | 物质的起始浓度 | 物质的平衡浓度 | ||
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.6 | 0.35 | |
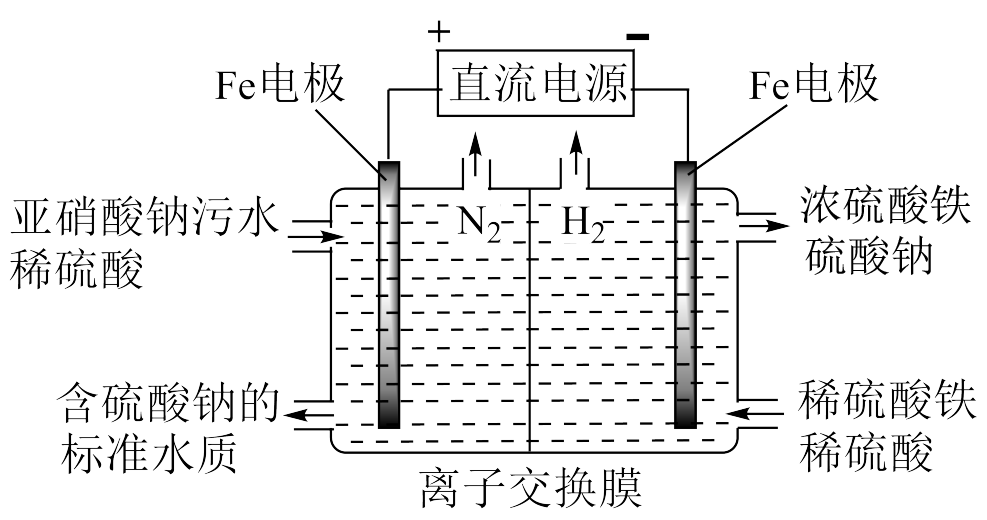
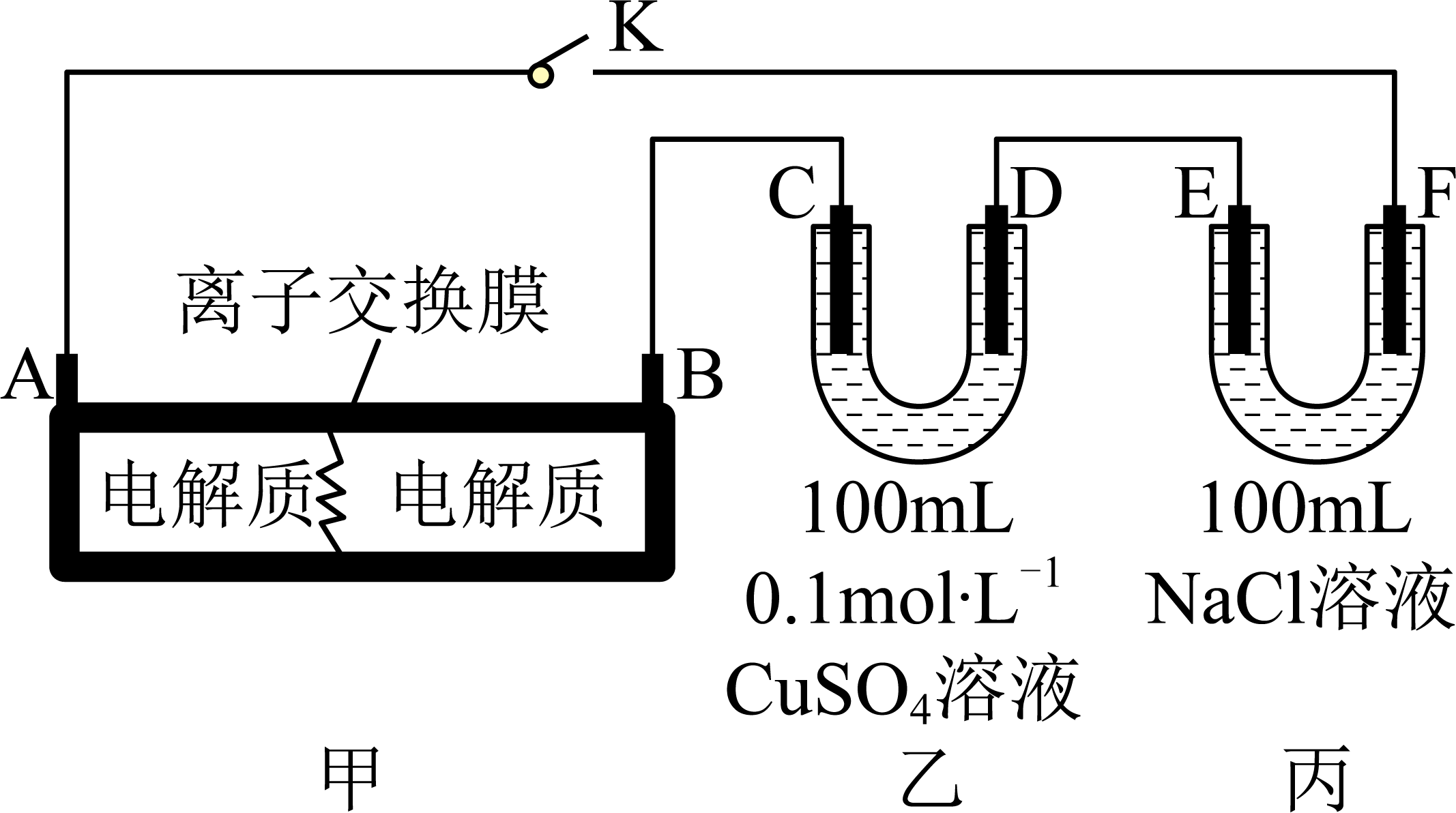
Ⅰ.如图装置甲是某可充电电池的示意图,该电池放电的化学方程式为 , 图中的离子交换膜只允许
通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,电极质量减少
。
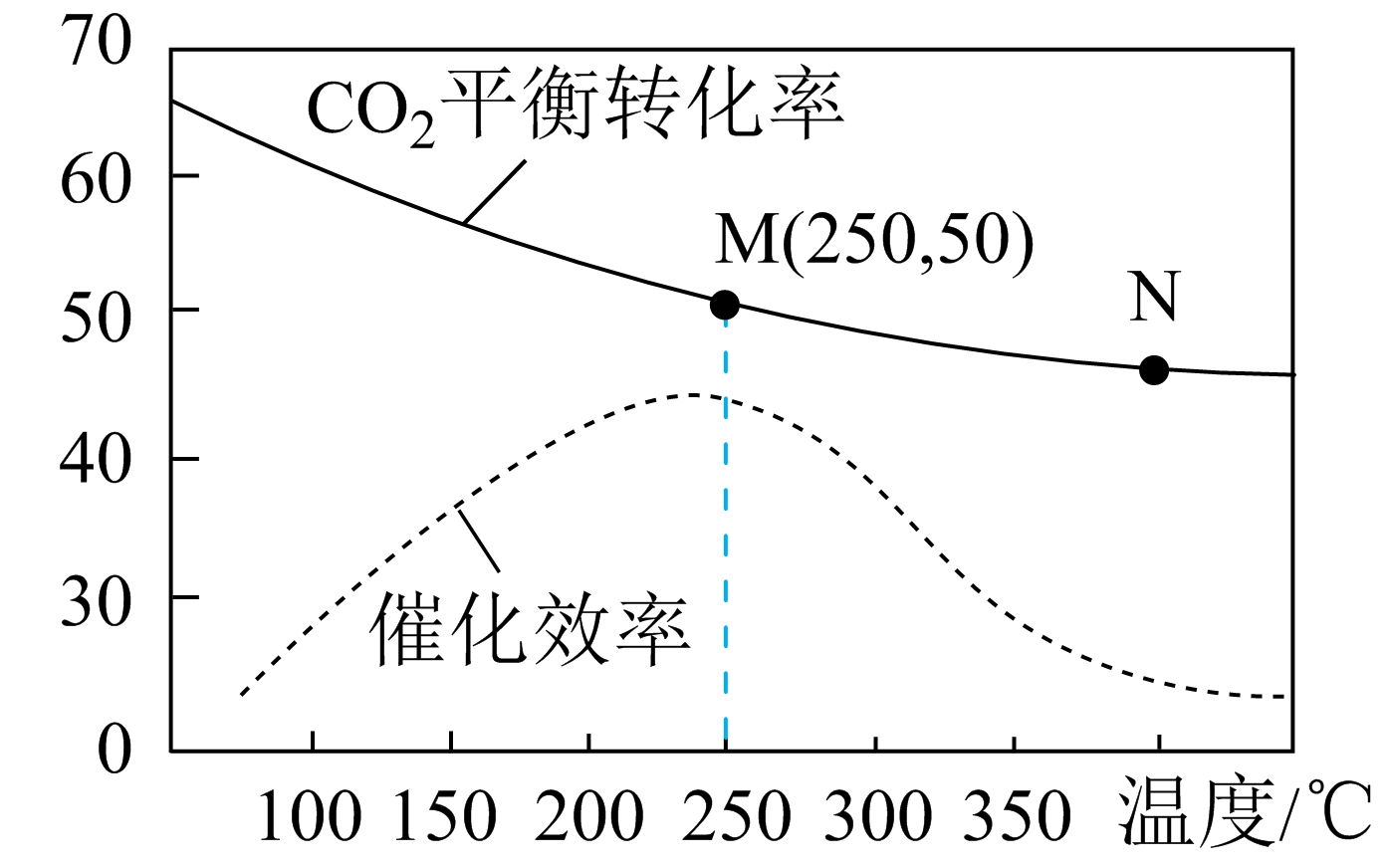
反应Ⅰ:
反应Ⅱ:
回答下列问题: