选项 | 实验操作和现象 | 结论 |
A | 向盛有饱和Na2S2O3溶液的试管中滴加稀盐酸,溶液变浑浊且有气体生成 | 说明生成了S和H2S |
B | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
C | 常温下,测得0.1 mol/LNaA溶液的pH大于0.1 mol/L Na2CO3溶液的pH | 酸性:HA<H2CO3 |
D | 向CuS的悬浊液中加入饱和MnSO4溶液可生成浅红色沉淀(MnS为浅红色) | 说明Ksp(MnS) < Ksp(CuS) |
①标准状况下,2.24 L四氯化碳含碳原子数为0.1NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为NA
③电解精炼铜时,若阴极得到电子数为2NA , 则阳极质量减少64 g
④7 g CnH2n中含有的氢原子数为2NA
⑤常温下,7.1 g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
⑥1 L 2 mol·L-1的FeCl3溶液中含Fe3+数为2NA
⑦2 L 1 mol·L-1的盐酸中所含氯化氢分子数为2NA
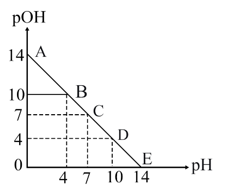
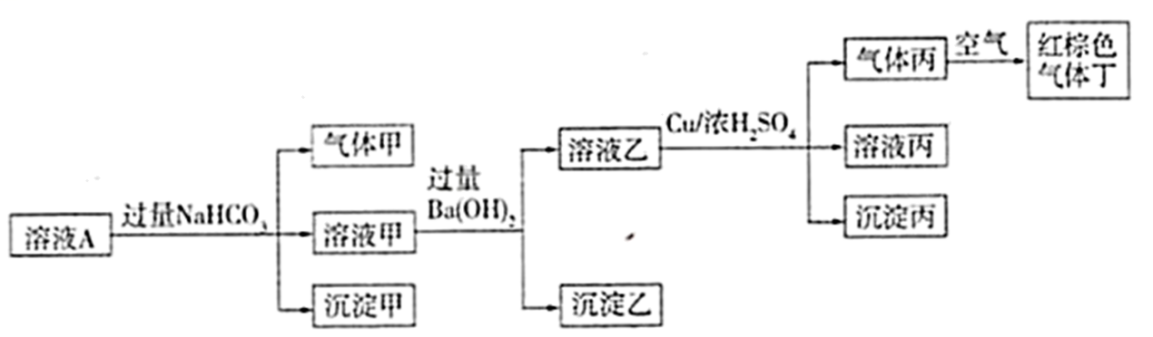
根据以上的实验操作与现象,下列有关说法不正确的是( ___ )
实验 | 实验操作和现象 |
1 | 测得10mL0.1mol·L-1NaHC2O4溶液的pH约为5.5 |
2 | 向酸性KMnO4溶液中滴加过量0.1mol·L-1NaHC2O4溶液,溶液紫红色褪色 |
3 | 向0.1mol·L-1NaHC2O4溶液中加入等体积0.1mol·L-1Ba(OH)2溶液,溶液变浑浊 |
4 | 向10mL0.1mol·L-1NaHC2O4溶液中滴加少量0.1mol·L-1NaOH溶液,无明显现象 |
下列说法正确的是( )
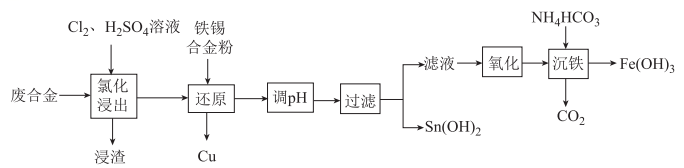
已知:常温下, ,
,
。
回答下列问题: