

选项 | 实验目的 | 实验方案 |
A | 测定NaClO溶液的pH | 取一张 pH 试纸放在表面皿上,用洁净的玻璃棒蘸取待测液滴于试纸的中部,与标准比色卡对比 |
B | 探究浓度大小对反应速率的影响 | 取等体积不同浓度的KMnO4溶液,分别加入等体积等浓度的H2C2O4溶液,观察褪色的快慢 |
C | 检验CH3CH2Br 中的溴原子 | 取少量CH3CH2Br与NaOH 水溶液共热,冷却,再加AgNO3溶液,观察产生沉淀的颜色 |
D | 探究KI与FeCl3反应的限度 | 取5mL 0.1mol/L KI溶液于试管中,加入1mL 0.1 mol/L FeCl3溶液,充分反应后再加KSCN溶液,观察现象 |
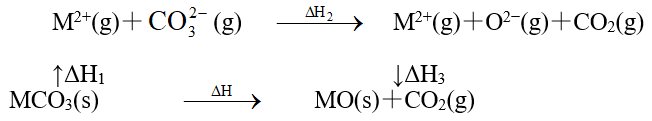
下列说法错误的是( ___ )
选项 | 物质 | 所用试剂 | 方法 |
A | 乙醇(水) | 新制生石灰 | 蒸馏 |
B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
D | 饱和碳酸钠溶液 | 过滤 |
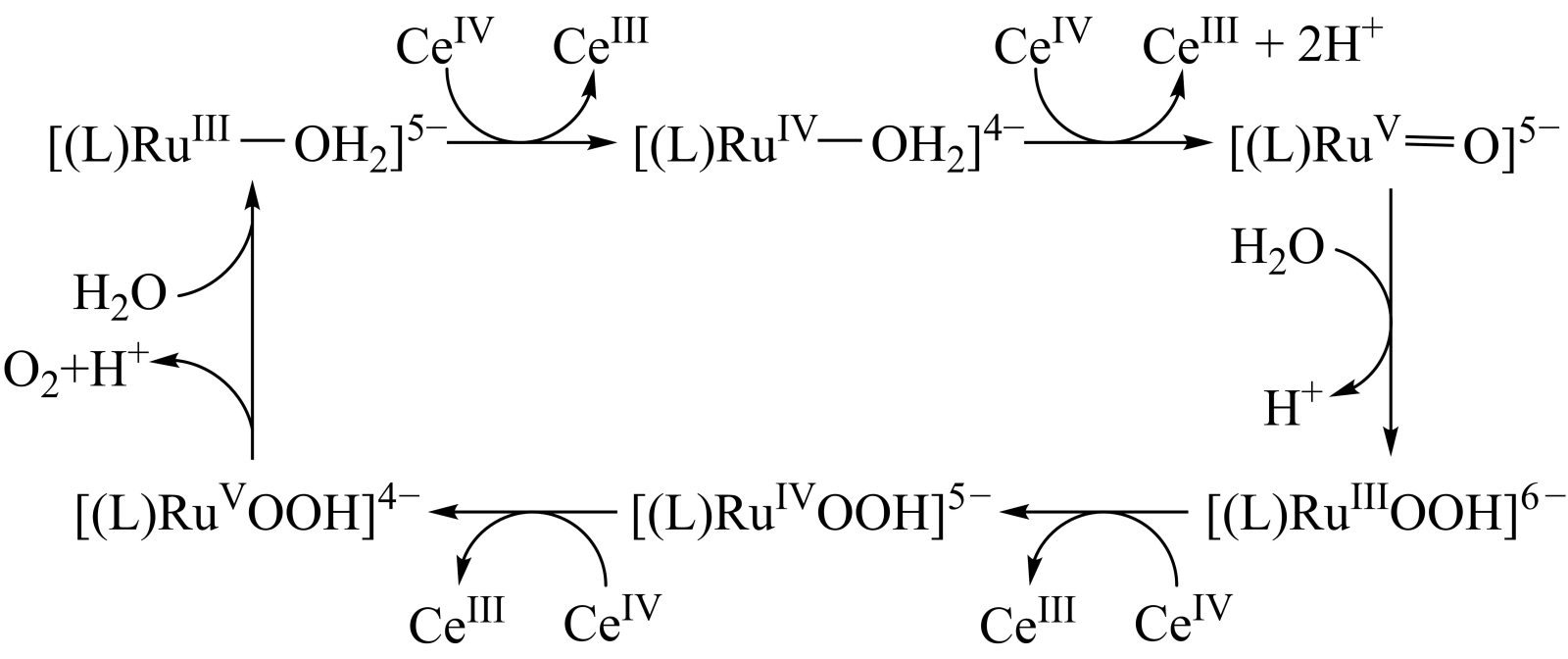
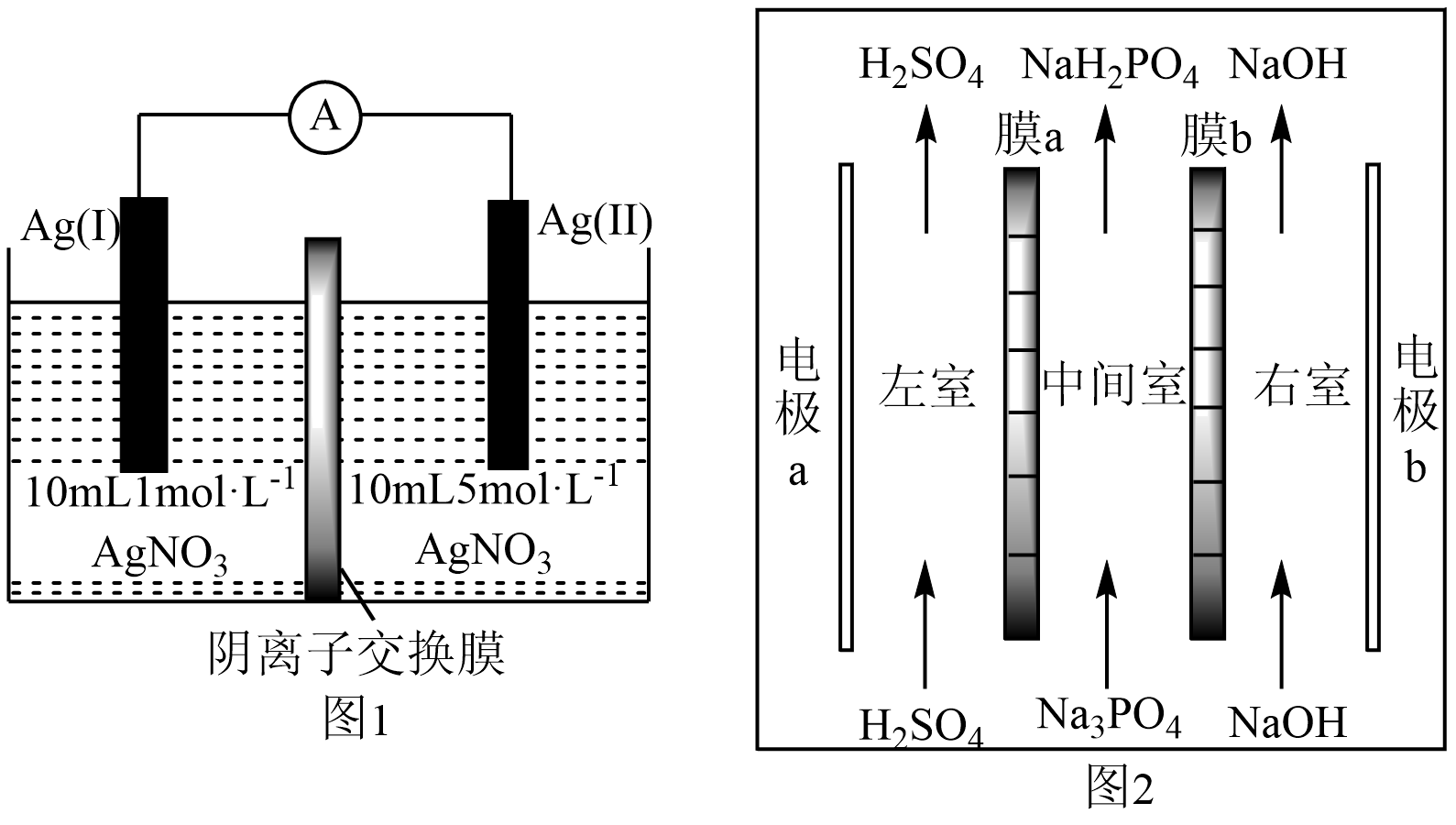
第一步:ClO-+H2OHClO+OH- K1=3.3×10-10
第二步:…… K2=……
第三步:HIO+OH-IO-+H2O K3=2.3×103
下列说法正确的是( )
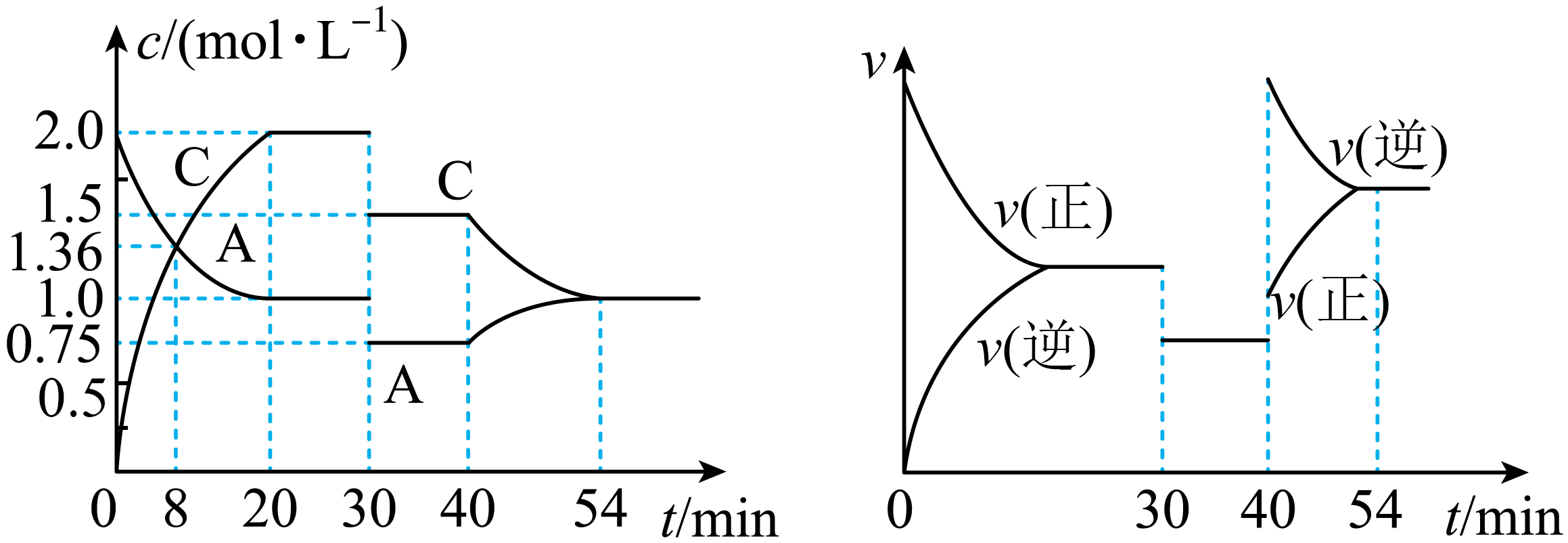
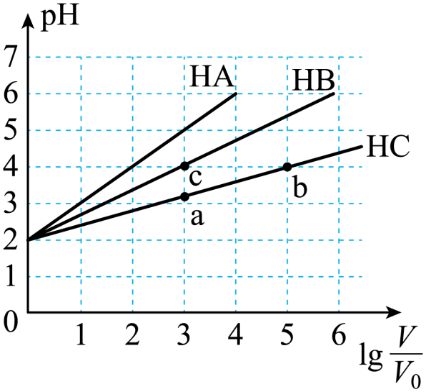
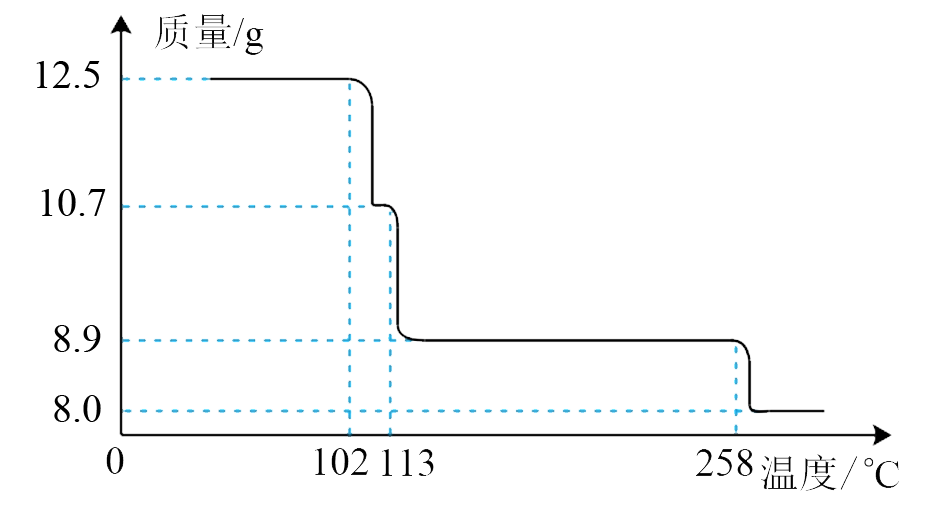
请回答下列问题:
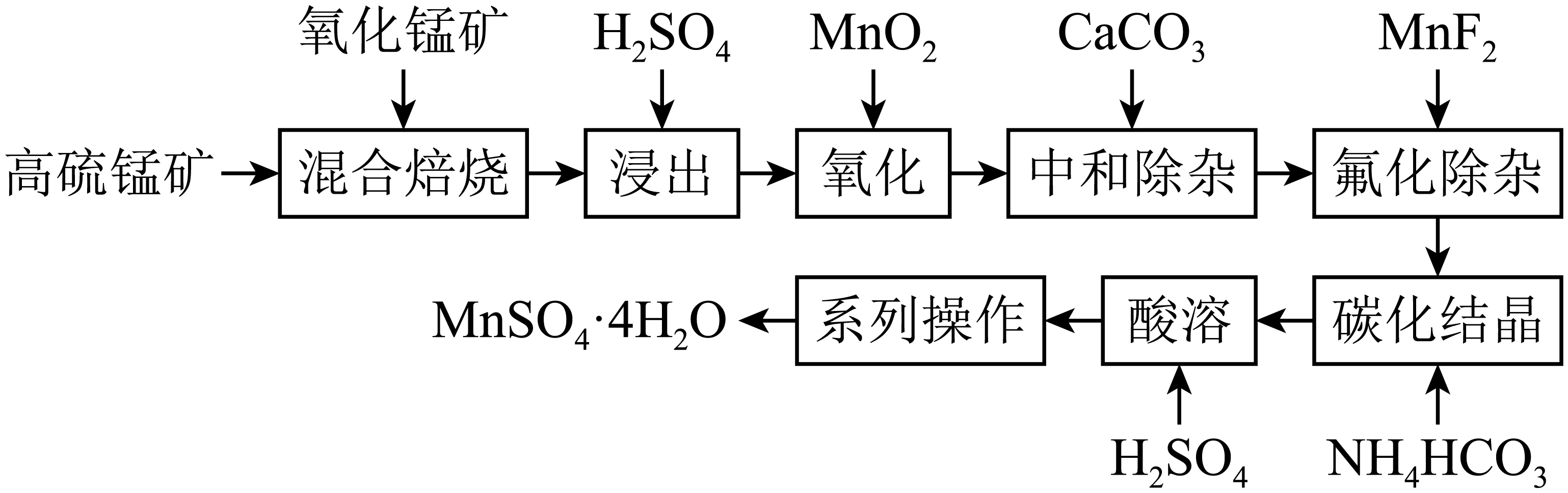
已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO
② Ksp(MgF2)=6.4×10-10(mol/L)3;Ksp(CaF2)=3.6×10-12(mol/L)3
③离子浓度≤10-5mol·L-1时,离子沉淀完全。请回答:
